1月31日,我校药学科学学院刘琦副教授团队在材料权威期刊《先进材料(Advanced Materials)》(中科院一区TOP,IF=27.4),发表了题为《一种用于肿瘤选择性蛋白降解和癌症免疫治疗的双功能溶酶体靶向嵌合体纳米平台(A Bifunctional Lysosome-Targeting Chimera Nanoplatform for Tumor-Selective Protein Degradation and Enhanced Cancer Immunotherapy)》的研究性论文。刘琦副教授为第一通讯作者,南开大学化学院刘阳教授为共同通讯作者,我校为第一通讯作者单位。这也是该团队独立后以第一通讯作者在《先进材料》发表的第二篇研究性论文。
靶向蛋白降解技术可以利用细胞固有蛋白降解系统,选择性清除目标蛋白,已经成为一种新颖的治疗方式。例如,溶酶体靶向嵌合体(Lysosome targeting chimeras, LYTACs)策略,可以高效将细胞外蛋白或膜蛋白转运到溶酶体中进行降解,但其肿瘤临床应用依然受限。第一,细胞或组织选择性LYTACs体系目前仍然缺乏,脱靶效应会引发严重的毒副作用;第二,现有LYTACs的代谢动力学和肿瘤富集较差;第三,传统LYTACs需要复杂的设计合成,蛋白和溶酶体靶向配体的固定比例难以调整;第四,实体瘤的复杂性和异质性严重削弱了单一疗法的疗效。
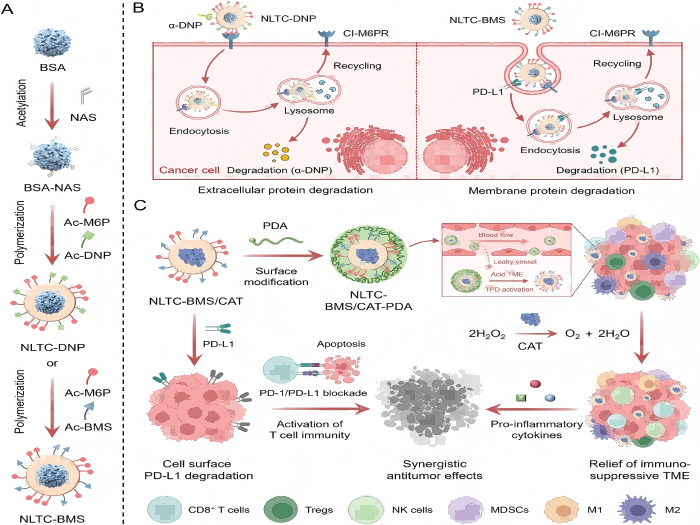
鉴于此,本文构建了一种新型LYTACs纳米平台(NLTC)。NLTC是一种具有功能表面的聚合物纳米胶囊,通过原位聚合技术在单个蛋白表面整合蛋白靶向配体、溶酶体靶向配体制备,可以有效降解特定细胞外蛋白和膜相关蛋白。区别于现有LYTACs策略,NLTC能够整合其它免疫调节功能。利用NLTC包载过氧化氢酶可以有效催化肿瘤组织内过氧化氢分解为氧气,从而缓解免疫抑制性肿瘤微环境。此外,对NLTC表面进行响应性修饰可避免NLTC在血液循环和正常组织中的非特异性激活,增强肿瘤富集和肿瘤选择性蛋白降解。动物实验结果证明,NLTC在静脉注射后能有效降解肿瘤细胞表面免疫检查点并缓解肿瘤免疫抑制性微环境,最终抑制恶性肿瘤的生长、复发和转移。
该研究获得国家自然科学基金、安徽省自然科学基金等的资助,也得到学校药学高峰学科平台的支持。(药学科学学院 科技产业部)
论文链接:https://doi.org/10.1002/adma.202417942
